|
mRNA疫苗研究解決方案
|
|
|
新冠疫情的出現讓疫苗再次備受關注。作為“疫苗軍團”中的一員�����,mRNA疫苗作為后起之秀熱度不斷攀升��。
體外轉錄的mRNA應用在動物實驗的首次報道是在1990年��,研究人員將報告基因的mRNA注射入小鼠骨骼肌����,并成功檢測到蛋白質的表達。然而��,由于這一時期缺少高效的mRNA遞送技術,加之RNA本身的不穩定性等原因���,在這一階段的研究過后����,mRNA療法并沒有走上快速發展的道路����。隨著相關研究的不斷投入,近年來涌現的各種創新型技術讓mRNA在疫苗研發領域嶄露頭角���,表現出很好的前景。
相比滅活疫苗等前代技術平臺�,mRNA技術在安全性、功效表現����,以及生產上均具有一定優勢���。mRNA不具備感染性�����、整合性,降低了發生感染或插入突變帶來的潛在風險����。各種修飾技術幫助mRNA提高了穩定性與可翻譯性,新的遞送方法讓mRNA可以快速進入到細胞中完成表達�。此外這些新技術新方法也為其安全性提供了進一步保障�����。通過體外轉錄技術���,mRNA可以被快速�����、大量地合成�,讓mRNA也同時具備了生產優勢。
|
|
|
|
Takara mRNA疫苗研究解決方案,為疫苗研發加速�����。
|
|
|
|
mRNA體外合成
|
|
生產mRNA主要通過體外合成方式進行����,體系中RNA聚合酶以DNA為模板體外轉錄得到mRNA。Takara提供多種mRNA合成工具酶及相關試劑。
|
|
2540A
|
T7 RNA Polymerase
|
5,000 U
|
|
2540B
|
T7 RNA Polymerase
|
5,000 U ×5
|
|
2520A
|
SP6 RNA Polymerase
|
3,000 U
|
|
2520B
|
SP6 RNA Polymerase
|
3,000 U ×5
|
|
2181
|
Poly(A) Polymerase
|
20 U
|
|
2270A
|
Recombinant DNase I (RNase-free)
|
1,000 U
|
|
2270B
|
Recombinant DNase I (RNase-free)
|
1,000 U ×5
|
|
2313A
|
Recombinant RNase Inhibitor
|
5,000 U
|
|
2313B
|
Recombinant RNase Inhibitor
|
5,000 U ×5
|
|
4041
|
ATP
|
25 μmol
|
|
4042
|
GTP
|
25 μmol
|
|
4043
|
CTP
|
25 μmol
|
|
4044
|
UTP
|
25 μmol
|
|
6141
|
Takara
IVTpro? mRNA Synthesis System
|
1
Kit
|
|
6143
|
Cloning
Kit for mRNA Template
|
10
Rxns
|
|
6144
|
Takara
IVTpro? T7 mRNA Synthesis Kit
|
20
Rxns
|
|
2541A
|
T7
RNA Polymerase ver.2.0
|
20000
U
|
|
2450A
|
Pyrophosphatase
(inorganic)
|
10
U
|
|
2450B
|
Pyrophosphatase
(inorganic)
|
10
U x5
|
|
|
新產品:Takara IVTpro? mRNA Synthesis System(Code No. 6141)
它是一款能夠簡便�、高效合成帶有Cap結構和Poly(A)序列的mRNA的體外轉錄試劑盒。
它包含以下兩種制品組分:
1)Cloning Kit for mRNA Template(Code No. 6143):用于構建參與體外轉錄反應的模板質粒。
試劑盒包含一個預線性化載體,作為模板質粒用于后續體外轉錄反應。此外還包含用于將目標DNA無縫克隆到預線性化載體的In-Fusion Snap Assembly Master Mix和FLuc對照片段���。
2)Takara IVTpro T7 mRNA Synthesis Kit(Code No. 6144):用于體外轉錄反應大量生成高質量的mRNA��。
試劑盒中含有優化的高效T7 RNA聚合酶���,獨立包裝的NTPs����,通過體外轉錄可合成大量mRNA。此外,還包含用于IVT反應后消化模板DNA的DNase I和用于純化mRNA的氯化鋰 (LiCl) 溶液。
本試劑盒配合使用CleanCap Reagent AG(TriLink公司的Cap類似物)可以高效制備具有Cap結構的mRNA�����。
※Cap類似物不包含在本產品中��,需另外準備CleanCap Reagent AG (TriLink公司)����。
新產品6141適用于目前研究熱點mRNA疫苗相關應用��。
它是一個完整的系統����,包含一個帶有T7啟動子的DNA模板質粒(6143)和IVT反應相關試劑(6144)��,直接滿足客戶從無到有,對mRNA合成工具的需求�。
6143中帶有的in-fusion試劑可以幫助客戶直接將目的基因克隆到DNA模板上�����,方便進行后續體外轉錄實驗���。使用6141每次反應(20 μl 反應體系)可以合成高達 200μg 或更多的RNA,在mRNA合成產量上在市面同類競爭產品中具有優勢��!
|
修飾酶新品:
1、2541A T7 RNA Polymerase ver.2.0
2541A是原有產品T7 RNA Polymerase(Code No. 2540A/B)的升級產品����,每個反應(20μl體系)的RNA合成量提高約7倍�����,性能更強��!
2���、2450A/B Pyrophosphatase (inorganic)
2450A/B是焦磷酸酶(無機)是一種催化無機焦磷酸鹽(PPi)水解產生正磷酸鹽的酶�����。該酶分解RNA和DNA合成反應中產生的副產物PPi,可促進合成反應的順利進行。
|
|
mRNA轉染
|
|
進行動物實驗前�,將mRNA轉染細胞是初步驗證所合成的mRNA是否有效的方法之一�。Takara Xfect RNA轉染試劑可以高效轉染多種類型RNA至哺乳動物細胞��,是包含轉染所需全部試劑的完整系統�����。
|
|
|
|
貨號
|
產品名稱
|
規格
|
|
631450
|
Xfect RNA Transfection Reagent
|
1.2 ml
|
|
|
|
|
Xfect是可生物降解的納米顆粒高分子聚合物轉染試劑��,可提供更低的細胞毒性和高轉染效率�,適用于廣泛的細胞類型����,保證高轉染效率的同時保持了更高的細胞活性。
|
|
|
|
實驗例
|
|
|
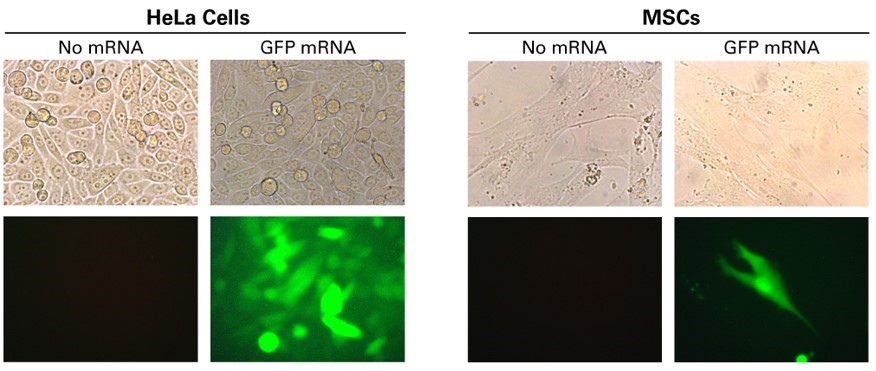
圖1. HeLa細胞與間充質干細胞(MSCs)轉染GFP mRNA��。HeLa細胞(2.0×105)和間充質干細胞(6.0×104)使用1 μg GFP mRNA和5 μl Xfect RNA轉染試劑進行處理��。20小時后�,通過落射熒光顯微鏡進行觀察�����。HeLa細胞圖像20倍放大�����,間充質干細胞圖像40倍放大。
|
|
|
|
轉染細胞中目標蛋白表達檢測(Western Blot分析)
|
|
Western Blot分析仍然是目前實驗室常用的檢測分析方法之一,廣泛應用于對目標蛋白質的檢測與分析���。轉染細胞后的mRNA會獲得怎樣的表達情況��,通過Western Blot檢測可以獲得一目了然的結果���。Takara提供豐富的Western Blot實驗相關試劑���,搭配詳細的實驗操作指南,提高Western Blot實驗效率�。
|
|
|
|
化學發光檢出用HPR底物
|
|
貨號
|
產品名稱
|
規格
|
|
T7101A
|
Western BLoT Chemiluminescence HRP Substrate
|
250 ml
|
|
T7101B
|
Western BLoT Chemiluminescence HRP Substrate
|
250 ml × 2
|
|
T7102A
|
Western BLoT Quant HRP Substrate
|
100 ml
|
|
|
|
|
抗原-抗體反應促進
|
|
貨號
|
產品名稱
|
規格
|
|
T7111A
|
Western BLoT Immuno Booster
|
250 ml each
|
|
T7115A
|
Western BLoT Immuno Booster PF
|
250 ml
|
|
|
|
|
HPR標識二抗替代
|
|
貨號
|
產品名稱
|
規格
|
|
T7122A
|
Western BLoT Rapid Detect v2.0
|
50 Rxns
|
|
|
|
|
封閉與洗脫
|
|
貨號
|
產品名稱
|
規格
|
|
T7131A
|
Western BLoT Blocking Buffer(Fish Gelatin)
|
1 L
|
|
T7132A
|
Western BLoT Blocking Buffer(Protein Free)
|
500 ml
|
|
T7135A
|
Western BLoT Stripping Buffer
|
500 ml
|
|
|
|
|
電泳緩沖液方便裝與蛋白質Marker
|
|
貨號
|
產品名稱
|
規格
|
|
3453A
|
CLEARLY Protein Ladder (Unstained)
|
500 μl
|
|
3454A
|
CLEARLY Stained Protein Ladder
|
500 μl
|
|
T9320A
|
TaKaRa CBB Protein Safe Stain
|
1 L
|
|
|
|
|
Western Blot實驗操作指南
|

|
|
|
|
病毒RNA檢測
|
|
|
|
動物實驗是檢驗疫苗效果的重要一環。這其中少不了對不同實驗組別動物體內病毒載量的檢測����。除了經典的組織病理學���、免疫組化方法外,快速����、靈敏的熒光定量PCR方法同樣不可少。Takara提供高質量的病毒核酸檢測相關產品����,加速研究進程。
|
|
|
|
探針法一步RT-PCR試劑與病毒核酸提取
|
|
貨號
|
產品名稱
|
規格
|
|
RR064A
|
One Step PrimeScript? RT-PCR Kit (Perfect Real Time)
|
100 Rxns
|
|
RR064B
|
One Step PrimeScript? RT-PCR Kit (Perfect Real Time)
|
100 Rxns × 5
|
|
RR600A
|
One Step PrimeScript? III RT-qPCR Mix
|
200 Rxns
|
|
RR600B
|
One Step PrimeScript? III RT-qPCR Mix
|
200 Rxns × 5
|
|
9766
|
TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0
|
50 Rxns
|
|
|
|
|
【文獻案例】
|
· Huang, Qingrui, et al. “A Single-Dose MRNA Vaccine Provides a Long-Term Protection for HACE2 Transgenic Mice from SARS-CoV-2.” Nature Communications, vol. 12, no. 1, 2021, pp. 776–776.
· Zhang, Na Na, et al. “A Thermostable MRNA Vaccine against COVID-19.” Cell, vol. 182, no. 5, 2020, pp. 1271–1283.
· Zhang, Cheng, et al. “Impact of Prior Infection on Severe Acute Respiratory Syndrome Coronavirus 2 Transmission in Syrian Hamsters.” Frontiers in Microbiology, vol. 12, 2021, pp. 722178–722178.
|
|
|
|
疫苗的研發是一場與病毒的賽跑��。科技不斷發展,技術不斷進步�����,人類的腳步從未停止向前。mRNA疫苗以及更多基于mRNA技術的治療方法將為人類的健康以及公共衛生安全事業持續貢獻力量
|
|
|
Takara為不同基因工程疫苗研究提供多種解決方案����,點擊下方專題�,了解更多信息��。
《重組腺病毒疫苗研究解決方案》
《重組蛋白疫苗研究解決方案》
|
|
|
|
參考文獻
|
· Wolff, Jon A., et al. “Direct Gene Transfer into Mouse Muscle in Vivo.” Science, vol. 247, no. 4949, 1990, pp. 1465–1413.
· Pardi, Norbert, et al. “mRNA Vaccines — a New Era in Vaccinology.” Nature Reviews Drug Discovery, vol. 17, no. 4, 2018, pp. 261–279.
· Karikó, Katalin, et al. “Incorporation of Pseudouridine into mRNA Yields Superior Nonimmunogenic Vector with Increased Translational Capacity and Biological Stability.” Molecular Therapy, vol. 16, no. 11, 2008, pp. 1833–1840.
· Kauffman, Kevin J., et al. “Materials for Non-Viral Intracellular Delivery of Messenger RNA Therapeutics.” Journal of Controlled Release, vol. 240, 2016, pp. 227–234.
· Guan, S., and J. Rosenecker. “Nanotechnologies in Delivery of mRNA Therapeutics Using Nonviral Vector-Based Delivery Systems.” Gene Therapy, vol. 24, no. 3, 2017, pp. 133–143.
· Thess, Andreas, et al. “Sequence-Engineered mRNA Without Chemical Nucleoside Modifications Enables an Effective Protein Therapy in Large Animals.” Molecular Therapy, vol. 23, no. 9, 2015, pp. 1456–1464.
· Karikó, Katalin, et al. “Generating the Optimal mRNA for Therapy: HPLC Purification Eliminates Immune Activation and Improves Translation of Nucleoside-Modified, Protein-Encoding mRNA.” Nucleic Acids Research, vol. 39, no. 21, 2011.
|