- 首頁
- 關于我們
- 友名生物
- Takara&Clontech介紹
- 促銷活動
- 新品上市
- 普通PCR酶
- 多功能酶:Tks Gflex
- 高保真酶:PrimeSTAR系列
- GMP-Grade Products
- 基本PCR:Taq系列
- TaKaRa Ex Taq?
- TaKaRa Ex Taq? Hot Start ...
- Premix Ex Taq? Hot Start ...
- Premix Taq? (Ex Taq? Vers...
- Premix Taq? (Ex Taq? Vers...
- TaKaRa LA Taq?
- TaKaRa LA Taq? with GC Bu...
- TaKaRa LA Taq? Hot Start ...
- Premix Taq? (LA Taq? Vers...
- Premix Taq? (LA Taq? Vers...
- Premix Taq? (LA Taq? Vers...
- GC Buffer
- TaKaRa Taq?
- TaKaRa Taq? Hot Start Ver...
- TaKaRa Taq? HS Perfect Mi...
- Premix Taq? (TaKaRa Taq? ...
- Premix Taq? Hot Start Ver...
- Premix Taq? (TaKaRa Taq? ...
- SpeedSTAR? HS DNA Polymer...
- TaKaRa Z-Taq?
- Powerful PCR:MightyAmp系列
- 直接電泳的酶制品
- 多重PCR,UNG防污染
- 高端PCR酶(Clontech)
- 以DNA為模板PCR kit
- 以RNA為模板PCR kit
- 熒光定量PCR相關制品
- cDNA合成和克隆
- 核酸提取純化
- 限制酶
- DNA-RNA-Protein Marker
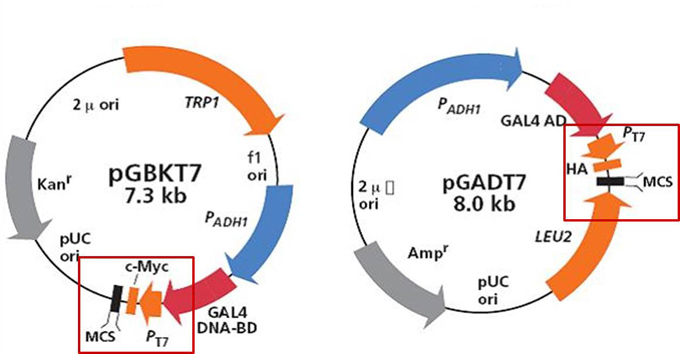
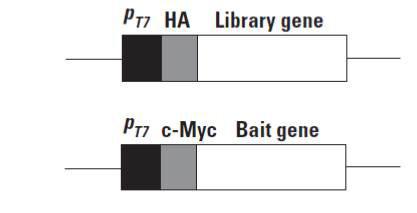
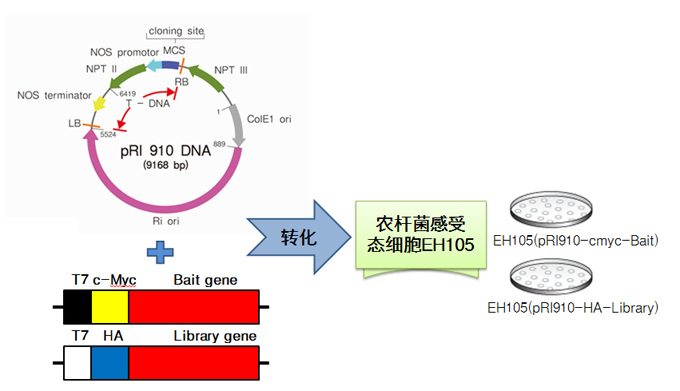
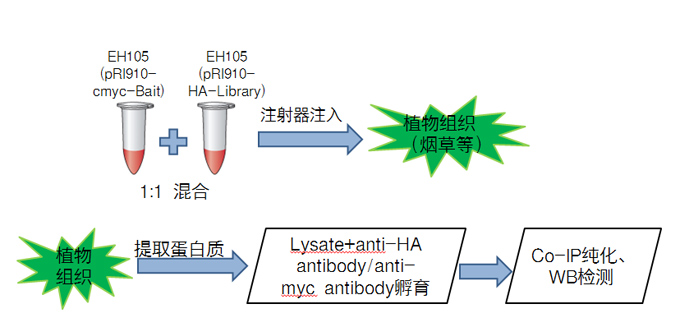
- 酵母單-雙雜交
- 蛋白質表達相關
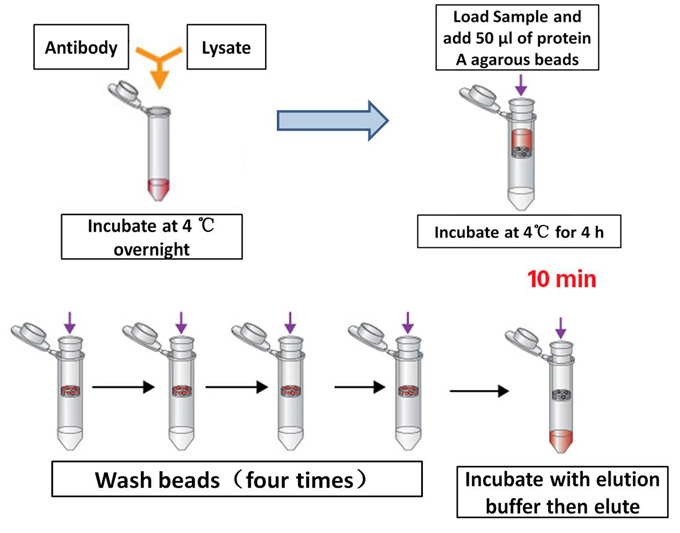
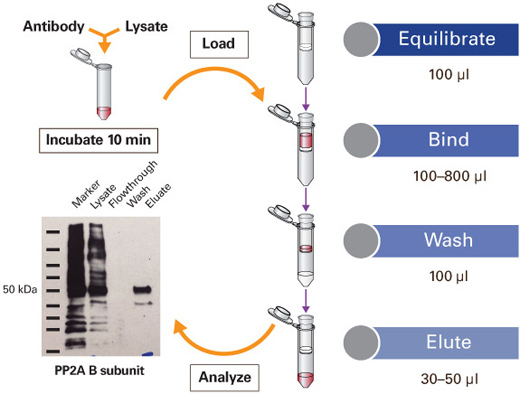
- 蛋白質純化與檢測
- 病毒表達系統
- 轉染相關
- 干細胞相關
- 干細胞基因操作 (Cell reprogrammi...
- 干細胞系 (Cell)
- 干細胞培養產品 (Cell culture)
- Human Stem Cell Culture S...
- Human Stem Cell Culture M...
- Rat stem cell culture med...
- Mouse ES and iPS stem cu...
- Mouse ES cell culture med...
- Mouse Neural Differentiat...
- Adherent Neural Stem Cell...
- Media Supplements (Ndiff ...
- Laminin Substrate iMatrix...
- Mouse Feeder Cell Quantif...
- Osteoblast-Inducer Reagen...
- Hepatic Cell Differentiat...
- 干細胞用抗體 (Antibodies)
- 干細胞分化試劑盒和全能性監測
- 甲基化研究
- 基因編輯相關
- 熒光蛋白報告示蹤
- 病理相關Elisa檢測
- 細胞及培養相關
- miRNA-RNAi相關
- 原位雜交(ISH)相關
- 食品-環境-人檢測
- PCR儀及耗材
- NGS相關
- RNA seq相關
- 單細胞RNA-Seq (dT Primed)
- V3單細胞RNA-Seq (dT Primed)
- SMART-Seq v4 (for Fluidig...
- 單細胞差異表達分析 (for Illumina)
- 皮克級鏈特異 Total RNA-Seq (for...
- 低起始量鏈特異RNA-Seq (Random P...
- 高起始量鏈特異總RNA-Seq (Random P...
- 通用型低起始量RNA-Seq (Random Pr...
- 人T細胞受體分析
- 小鼠T細胞受體分析
- 非編碼RNA RNA-Seq (for Illum...
- 靶向RNA-Seq (for Illumina)
- 核糖體RNA去除
- 測序文庫構建 (dsDNA) (Illumina ...
- NGS文庫定量
- 磁力分離器
- 單細胞裂解緩沖液
- DNA seq相關
- NGS用PCR酶
- NGS與DNA甲基化
- NGS與染色質免疫共沉淀ChIP
- RNA seq相關
- 實驗室耗材
- Takara&Clontech介紹
- 安和生物
- 技術與服務
- 新聞動態
- 聯系我們